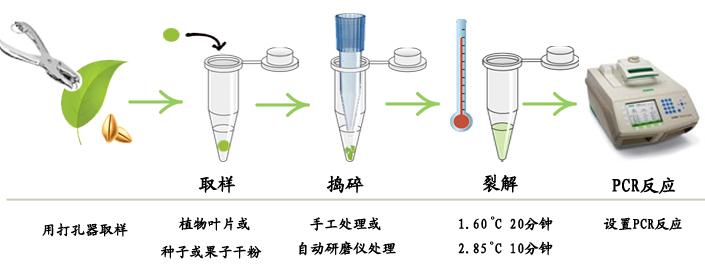
馬巴貝斯蟲探針法熒光定量PCR試劑盒是從土壤農(nóng)桿菌 CP4 菌株中分離得到的抗除草劑草甘膦基因,是轉(zhuǎn) 基因植物研究中最為常用的一種篩選標記基因,因此本公司根據(jù)探針法 qPCR 原理開發(fā) 了專門用于檢測馬巴貝斯蟲探針法熒光定量PCR試劑盒的試劑盒,它具有下列特點: 1. 即開即用,用戶只需要提供樣品 DNA 模板。 2. 根據(jù)馬巴貝斯蟲探針法熒光定量PCR試劑盒保守區(qū)域設(shè)計引物和探針,能專一性地檢測出樣品中的馬巴貝斯蟲探針法熒光定量PCR試劑盒成分,但不能檢測其他非馬巴貝斯蟲探針法熒光定量PCR試劑盒成分。 3. 提供陽性對照,便于區(qū)分陰性樣品。 4. 一管式閉管操作,降低了交叉污染。 5. 快速,整個檢測過程(按一個樣品計)所需時間僅為 2.0 小時。 6. 本只能用于科研,足夠 50 次 20uL 體系的探針法熒光定量 PCR。
馬巴貝斯蟲探針法熒光定量PCR試劑盒本實用新型專利技術(shù)公開了一種實時熒光定量PCR試劑盒,包括盒體,盒體由上盒體和下盒體組成,上盒體的底面上設(shè)有限位凸起,下盒體的頂面上設(shè)有與限位凸起匹配的凹槽,且在下盒體左右側(cè)壁的下端均軟連接有側(cè)蓋,側(cè)蓋遠離下盒體的一端連接有卡勾,下盒體的上端邊緣處設(shè)有環(huán)形凸起,兩個卡勾分別勾住環(huán)形凸起的左右兩端將上盒體固定在下盒體上;凹槽的內(nèi)部設(shè)有固定桿,固定桿上通過轉(zhuǎn)動件轉(zhuǎn)動連接有用于放置試管的試管架;下盒體的左右兩側(cè)均設(shè)置有收納槽。本實用新型專利技術(shù)通過將盒體分為上下組合的兩個部分,并將兩個部分通過側(cè)蓋連接,即可保證試劑盒的便攜性,同時使用試劑盒自帶的試管可提高檢測的效率。
產(chǎn)品特點
1. 使用化學(xué)修飾的熱啟動聚合酶,反應(yīng)特異性高,*程度地避免了非特異擴增;
2. 反應(yīng)緩沖液經(jīng)充分優(yōu)化,反應(yīng)靈敏快速,40個循環(huán)只需20多分鐘;
3. 抗干擾能力強,反應(yīng)重復(fù)性高,適合對土壤、糞便、腫瘤和血液來源的復(fù)雜樣本中的靶基因進行檢測分析。
在PCR反應(yīng)體系中加入熒光基團,利用熒光信號積累實時監(jiān)測整個PCR進程,zui后通過標準曲線對未知模板進行定量分析的方法。
特異性熒光標記:
TaqMan法
TaqMan探針的特性:
(1)5′端標記有報告基團(Reporter, R),如FAM、VIC等
(2)3′端標記有熒光淬滅基團 (Quencher, Q)
(3)探針完整,R所發(fā)射的熒光能量被Q基團吸收 ,無熒光, R與Q分開,發(fā)熒光
(4)Taq酶有 5′→3′外切核酸酶活性,可水解探針
相對定量通過內(nèi)標定量:
內(nèi)標(Endogenous Control)通常是β-actin、GAPDH基因等看家基因,在細胞中的表達量或在基因組中的拷貝數(shù)恒定,受環(huán)境因素影響小,內(nèi)標定量結(jié)果代表了樣本中所含細胞或基因組數(shù)量。
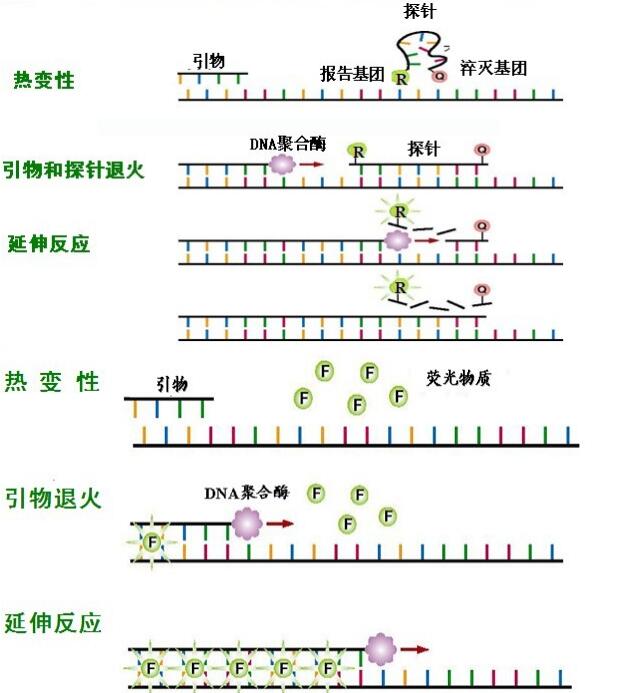
熒光定量PCR檢測方法包括以下步驟:
(1)將 馬巴貝斯蟲探針法熒光定量PCR試劑盒參照基因與待測目的基因片段等比例連接,克隆到同一個質(zhì)粒載體上,構(gòu)建一種可同時用于參照基因以及待測目的基因擴增檢測的標準品,并將所得標準品按照濃度梯度稀釋后同時用于繪制參照基因以及待測目的基因的標準曲線;
(2)待測樣本與步驟(1)所述標準品經(jīng)同步進行實時熒光定量PCR擴增后,目的基因與參照基因按照各自的標準曲線計算各自的拷貝數(shù),計算待測樣本的目的基因與參照基因拷貝數(shù)比值,即得目的基因的拷貝數(shù)相對定量檢測結(jié)果。
其中步驟(1)為:將參照基因與待測目的基因片段等比例連接,克隆到同一個質(zhì)粒載體上,構(gòu)建一種可同時用于參照基因以及待測目的基因擴增檢測的標準品,并將所得標準品按照濃度梯度稀釋后同時用于繪制參照基因以及待測目的基因的標準曲線。
其中所述參照基因為本領(lǐng)域常規(guī)參照基因,較佳地管家基因,優(yōu)選地為RPPH1的擴增區(qū)域,其中所述質(zhì)粒載體為本領(lǐng)域常規(guī)質(zhì)粒載體,較佳地為PCR克隆載體,優(yōu)選地為TA cloning載體,所述TA cloning載體較佳地為pMD18-T載體。其中所述標準品的核酸序列如序列表中SEQ ID NO:6所示。所述的等比例較佳地為1:1。由于標準品中待測目的基因與參照基因的比例為1:1,解決了目前相對標準曲線法應(yīng)用中目的基因與參照基因的濃度比例關(guān)系難以控制的問題,提高HER2基因擴增檢測的可靠性。
步驟(2)為:待測樣本與步驟(1)所述標準品經(jīng)同步進行實時熒光定量PCR擴增后,目的基因與參照基因按照各自的標準曲線計算各自的拷貝數(shù),計算待測樣本的目的基因與參照基因拷貝數(shù)比值,即得目的基因的拷貝數(shù)相對定量檢測結(jié)果。
其中所述待測目的基因為本領(lǐng)域常規(guī)待測目的基因,較佳地為腫瘤或者疾病的特異性基因,更佳地為HER2基因的擴增區(qū)域,所述熒光定量PCR擴增為本領(lǐng)域常規(guī)熒光定量PCR擴增方法,所述熒光定量PCR擴增方法較佳地為多通道熒光定量PCR擴增,更佳地為雙通道熒光定量PCR擴增。
 13585831301
13585831301 021-59541103 021-60443211
021-59541103 021-60443211 3004967995
3004967995 13585831301
13585831301 021-59541103 021-60443211
021-59541103 021-60443211 3004967995
3004967995