保存條件:-20℃冰凍保存一年。
工作原理:
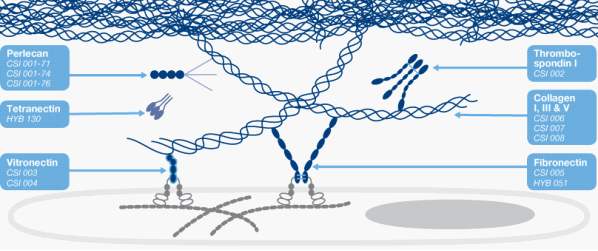
在機體內部隨時都在發生著細胞的死亡。傳統上用顯微鏡來觀察細胞的死亡,其特征為核染色質的濃縮及碎片的形成。但是這種現象出現的很晚,時間也很短暫。凋亡的特征是內 源性核酸內切酶被激活,細胞自身的染色質或DNA 被切割,出現單鏈或雙鏈缺口,并產生 與 DNA 斷點數目相同的3’-OH 末端。末端脫氧核糖核酸轉移酶(Terminal deoxynucleotidyl Transferase)可以將地高辛標記的dUTP(DIG-dUTP)標記至 3’-OH 末端,DIG-dUTP 結 合在 DNA 斷點部位,可以通過生物標記的抗地高辛抗體(Anti-DIG-Biotin)反應后,再結合 鏈酶親和素-熒光素 CY3(SABC-CY3)。Cy3 在 554nm 激化,在 568-574nm 發射熒光,呈鮮紅色,從而可以在顯微鏡下觀察到著色的凋亡細胞。
試劑盒內容:
1.標記緩沖液(Labeling Buffer)1ml
2.末端脫氧核糖核酸轉移酶(TdT,×20)20μl
3.DIG-dUTP(×20)20μl
4.封閉液(Blocking Reagent)4ml
5.生物素化抗地高辛抗體(× 100)20μl
6.SABC-CY3(× 100)20μl
7.Proteinase K(×200)50μl
8 抗體稀釋液 4ml
陽性對照片 2 張
用戶自備試劑
1.多聚賴氨酸或APES。
2.0.01M TBS,PH7.5(配法:1L 雙蒸餾水中加入 8.5 克氯化鈉,1.2 克 Tris和0.45—0.5ml 純 乙酸。)
3.DAPI 染色液
4.水溶性封片劑或抗熒光衰減封片劑。
操作步驟
1.樣品處理
(1)玻片預先用多聚賴氨酸或APES 進行處理。
(2)細胞涂片和冰凍切片:最重要的是及時固定。用4%多聚甲醛/0.01MPBS(PH7.0---7.6)室溫下固定30—60分鐘。0.01M PBS洗2分鐘×2次。蒸餾水洗滌2分鐘×2次。
(3)組織:有條件時應及時固定。常規 4%多聚甲醛/0.01M PBS(PH7.0---7.6)或10%中性緩沖 福爾馬林固定 4 小時以上,石蠟包埋。切片常規脫蠟入水(脫蠟務必干凈)。
2.標本片加 0.01M TBS 1:200 新鮮稀釋 Proteinase K 37℃消化 1—15分鐘,0.01MTBS洗2分鐘×3次。(細胞涂片和冰凍切片一般不消化或消化 10—60 秒鐘。新鮮石蠟切片消化 5-10分鐘。陳舊石蠟切片消化10-15分鐘)。
3.標本片加標記緩沖液(Labeling Buffer)20μl/片,以保持切片濕潤。按每張切片取TdT和 DIG-d-UTP 各 1μl ,加入18μl標記緩沖液中,混勻。甩去切片上多余液體后加 標記液,20μl/片。置樣品于濕盒中,37℃標記2小時。
4.0.01M TBS洗2分鐘×3次。
5.加封閉液 50μl/片,室溫 30分鐘,甩掉封閉液,不洗。
6.用抗體稀釋液 1:100 稀釋生物素化抗地高辛抗體:(取 1ml 抗體稀釋液加生物素化抗地 高辛抗體 10μl),混勻后 50μl/片加至標本片上。置樣品于濕盒中,37℃反應30分鐘。0.01M TBS洗2分鐘×3次。
7.用抗體稀釋液 1:100 稀釋 SABC:取 1ml 抗體稀釋液加 SABC 10μl ,混勻后50μl/ 片加至切片。37℃反應 30分鐘。0.01M TBS洗5分鐘×4次。
8.必要時可用 DAPI 染色液(貨號 AR1176,AR1177)輕度復染,蒸餾水洗。抗熒光衰減封 片劑封片(可用甘油代替)。熒光顯微鏡觀察。
結果判定:細胞核中有鮮紅色顆粒者為陽性細胞,即凋亡的細胞。
注意事項:
1.試劑盒嚴格-20℃存放。
2.初用時如試管底部無可見的試劑,在離心機離心 5分鐘,使試劑沉至管底。
3.檢測過程中切勿使樣品干涸。
 13585831301
13585831301 021-59541103 021-60443211
021-59541103 021-60443211 3004967995
3004967995 13585831301
13585831301 021-59541103 021-60443211
021-59541103 021-60443211 3004967995
3004967995